Azot
Właściwości fizyczne azotu: Gaz bezbarwny, bezwonny, niepalny, słabo rozpuszcza się w wodzie.
Azot występuje w postaci cząsteczek N2, w których azot połączony jest bardzo trwałym wiązaniem potrójnym N≡N. Wiąże się z tym bardzo mała reaktywność azotu.
Tlenki azotu
| Tlenek azotu(I) | N2O | bezbarwny gaz | charakter obojętny |
| Tlenek azotu(II) | NO | bezbarwny gaz | charakter obojętny |
Otrzymywanie:
N2 + O2 —Temp.→ 2NO
3Cu + 8HNO3(rozc.) → 3Cu(NO3)2 + 2NO + 4H2O
Tlenek azotu(II) ma 1 niesparowany elektron, co powoduje, że jest bardzo reaktywny.
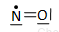
| Tlenek azotu(III) | N2O3 | bezbarwny gaz | charakter kwasowy |
Reakcja z wodą z wodą: N2O3 + H2O → 2HNO2
Reakcja z zasadą: N2O3 + 2NaOH → 2NaNO2 + H2O
| Tlenek azotu(IV) | NO2 | czerwonobrunatny, trujący gaz o ostrej woni. | charakter kwasowy |
Otrzymywanie
2NO + O2 → 2NO2
Cu + 4HNO3(stęż.) → Cu(NO3)2 + 2NO2 + 2H2O
Reakcja z wodą: 2NO2 + H2O → HNO2 + HNO3
Azot ma 1 niesparowany elektron i dlatego tlenek azotu(IV) łatwo dimeryzuje:
2NO2 ⇄ N2O4 tetratlenek diazotu (bazbarwny)
Wraz ze spadkiem temperatury stopień dimeryzacji rośnie.
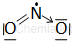
Załóż konto
Zyskaj dostęp do artykułów, które przekształcą skomplikowane zagadnienia chemiczne w zrozumiałe i interesujące treści.
Każdy artykuł, który przeczytasz, zwiększy Twoje zrozumienie i zaciekawienie chemią.
Nie czekaj, zacznij swoją naukową podróż już dziś!
| Pełny tekst dostępny jest tylko dla zalogowanych |
Treść strony i wszystkie elementy strony chem24.pl podlegają ochronie prawnej zawartej w przepisach o prawie autorskim.
Niedozwolone jest kopiowanie, rozpowszechnianie i udostępnianie innym użytkownikom bez zgody autora.
Niedozwolone działania stanowią okradanie autora i podlegają przepisom zawartym w Kodeksie Karnym.
