Tlenki
Tlenki to dwuskładnikowe związki tlenu z innymi pierwiastkami.
Wzór ogólny tlenków: XaOb
| X - atom dowolnego pierwiastka | a - ilość atomów pierwiastka X |
| O - atom tlenu | b - ilość atomów tlenu |
Ustalanie wzoru sumarycznego tlenku - metoda krzyżowa. Przenosimy wartościowość jednego pierwiastka za symbol drugiego pierwiastka. Powstałe indeksy dzielimy przez największy wspólny dzielnik.
Przykład.
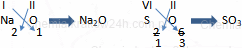
Większość wzorów sumarycznych można w taki sposób wyprowadzić, jednak są wyjątki np. P4O10. Sumaryczny wzór tego tlenku wynika z jego struktury.
Nazwy tlenków podaje się według schematu:
[tlenek (nazwa pierwiastka) (wartościowość pierwiastka)],
jeśli pierwiastek ma tylko jedną wartościowość wówczas nie podaje się jej.
Przykłady:
Fe2O3 tlenek żelaza (III), tlenek żelaza(II) FeO, CuO tlenek miedzi(II), Cu2O tlenek miedzi(I), SO3 tlenek siarki(VI), SO2 tlenek siarki(IV), Na2O tlenek sodu, MgO tlenek magnezu
Niektóre sposoby otrzymywania tlenków
I. Reakcje syntezy pierwiastków z tlenem - utlenianie. Tym sposobem można otrzymać najwięcej tlenków.
Przykłady
| 4Al + 3O2 → 2Al2O3 | 2Mg + O2 → 2MgO |
| 2H2 + O2 → 2H2O | 2Fe + O2 → 2FeO |
II. Przyłączenie tlenu do tlenków - może zajść wówczas, gdy pierwiastek połączony z tlenem ma inne, wyższe wartościowości
2SO2 + O2 → 2SO3 tlenek siarki(IV) → tlenek siarki(VI)
2Cu2O + O2 → 2CuO tlenek miedzi(I) → tlenek miedzi(II)
2NO + O2 → 2NO2 tlenek azotu(II) → tlenek azotu(IV)
2CO + O2 → 2CO2 tlenek wegla(II) → tlenek wegla(IV)
4FeO + O2 → 2Fe2O3 tlenek żelaza(II) → tlenek żelaza(III)
Wiązania w tlenkach
Pierwiastki grup 1, 2 i 13 tworzą z tlenem wiązania jonowe.
Pierwiastki grup 14-17 tworzą z tlenem wiązania kowalencyjne spolaryzowane.
Podział tlenków
Tlenki niemetali. Np. SO2, SO3, NO2, N2O3, P3O6, P4O10, CO2, ClO2, Cl2O6
Tlenki metali. Np. Na2O, K2O, MgO, NiO, CuO, PbO, Al2O3, ZnO, Fe2O3
Zapraszam do wpisania komentarza: uwagi, co jeszcze dopisać, objaśnić, sprecyzować, niezrozumiała treść, błędy itp.
Napisz komentarz
Treść strony i wszystkie elementy strony chem24.pl podlegają ochronie prawnej zawartej w przepisach o prawie autorskim.
Niedozwolone jest kopiowanie, rozpowszechnianie i udostępnianie innym użytkownikom bez zgody autora.
Niedozwolone działania stanowią okradanie autora i podlegają przepisom zawartym w Kodeksie Karnym.
