Alotropia
Alotropia - występowanie odmian tego samego pierwiastka różniących się właściwościami fizycznymi i chemicznymi. Odmiany alotropowe pierwiastka mogą różnić się między sobą strukturą krystaliczną lub liczbą atomów w cząsteczce.
Alotropia węgla
Odmiany alotropowe węgla: grafit, diament, grafen, fulereny, lonsdaleit i inne.
Grafit
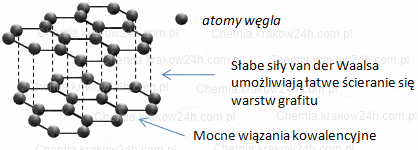
Budowa kryształu grafitu
Struktura grafiru składa się z płaskich warstw atomów węgla, które są ułożone jedna na drugiej. Każda warstwa, zwana warstwą grafenową, składa się z atomów węgla ułożonych w regularne sześciokąty. Atomy węgla w obrębie każdej warstwy są silnie połączone ze sobą, podczas gdy między warstwami występują tylko słabe oddziaływania, co sprawia, że warstwy łatwo się od siebie oddzielają, przez co grafit jest miękki, śliski i może się ścierać.
Wewnątrz warstwy są wiązania kowalencyjne typu σ, między warstwami są słabe, zdelokalizowane wiązania typu π. Dzięki tej delokalizacji grafit przewodzi prąd elektryczny.
Właściwości grafitu
- Grafit ma wysoką temperaturę topnienia (3500-4000 oC), co czyni go odpornym na wysokie temperatury.
- Jest dobrym przewodnikiem ciepła i elektryczności, co jest wynikiem swobodnego przepływu elektronów w jego strukturze.
- Ciemnoszary, bardzo miękki i śliski, co czyni go idealnym materiałem do produkcji ołówków i smarów.
Zastosowanie grafitu
- Grafit jest używany do produkcji ołówków, gdzie jego miękkość i zdolność do łatwego ścierania są wykorzystywane do tworzenia znaków na papierze.
- Jest również używany jako suchy smar w wielu zastosowaniach przemysłowych, gdzie jego śliskość pomaga zmniejszyć tarcie między ruchomymi częściami.
- W przemyśle metalurgicznym, grafit jest używany jako element grzejny w piecach elektrycznych do produkcji stali oraz jako tygle ogniotrwałe.
- Ze względu na swoją odporność na wysokie temperatury i korozję, grafit jest często używany w przemyśle jądrowym jako moderator w reaktorach jądrowych oraz robi się z niego tygle ogniotrwałe.
Diament
Nie przewodzi prądu elektrycznego, dobrze przewodzi ciepło, bardzo twardy, posiada połysk, jest przezroczysty.
Atomy w diamencie są równomiernie rozłożone, mocne wiązania typu sigma mają taką samą długość - każdy atom połączony jest z 4 innymi atomami. Kryształ ma kształt czworościanu foremnego.
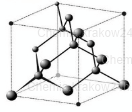
Zastosowanie: noże do cięcia szkła, wiertła, w jubilerstwie (brylanty)
Załóż konto
Zyskaj dostęp do artykułów, które przekształcą skomplikowane zagadnienia chemiczne w zrozumiałe i interesujące treści.
Każdy artykuł, który przeczytasz, zwiększy Twoje zrozumienie i zaciekawienie chemią.
Nie czekaj, zacznij swoją naukową podróż już dziś!
| Pełny tekst dostępny jest tylko dla zalogowanych |
Treść strony i wszystkie elementy strony chem24.pl podlegają ochronie prawnej zawartej w przepisach o prawie autorskim.
Niedozwolone jest kopiowanie, rozpowszechnianie i udostępnianie innym użytkownikom bez zgody autora.
Niedozwolone działania stanowią okradanie autora i podlegają przepisom zawartym w Kodeksie Karnym.
