Aldehydy
Wzór ogólny: R−CHO lub Ar−CHO
R-grupa węglowodorowa alifatyczna, Ar-grupa węglowodorowa aromatyczna,
grupa funkcyjna: −CHO grupa aldehydowa
grupa karbonylowa >C=O
Tworzenie nazwy (*preferowane nazwy IUPAC)
Do nazwy odpowiedniego węglowodoru dodaje się końcówkę -al.
Atom węgla wchodzący w skład grupy −CHO numeruje się zawsze jako 1.
W użyciu są również nazwy zwyczajowe
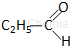
Pierwsze związki w szeregu homologicznym aldehydów alifatycznych:
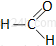 |
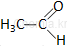 |
 |
|
metanal |
etanal |
propanal* |
Aldehyd aromatyczny
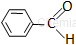 |
aldehyd benzoesowy benzaldehyd* |
W nazewnictwie aldehydów aromatycznych węgiel grupy aldehydowej również otrzymuje lokant 1.
Izomeria łańcuchowa - przykład C4H8O:
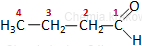 |
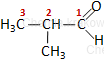 |
| butanal | 2-metylopropanal |
Masz już w sobie przekonanie, że potrzebujesz wsparcia, aby odkryć fascynujący świat chemii, w codziennej nauce i przygotowaniu do matury?
Załóż konto
Zyskaj dostęp do artykułów, które przekształcą skomplikowane zagadnienia chemiczne w zrozumiałe i interesujące treści.
Każdy artykuł, który przeczytasz, zwiększy Twoje zrozumienie i zaciekawienie chemią.
Nie czekaj, zacznij swoją naukową podróż już dziś!
Załóż konto
Zyskaj dostęp do artykułów, które przekształcą skomplikowane zagadnienia chemiczne w zrozumiałe i interesujące treści.
Każdy artykuł, który przeczytasz, zwiększy Twoje zrozumienie i zaciekawienie chemią.
Nie czekaj, zacznij swoją naukową podróż już dziś!
| Pełny tekst dostępny jest tylko dla zalogowanych |
Copyright 2011-2024Chem24.pl
Wszelkie prawa autorskie do treści zawartych w serwisie chem24.pl należą do właściciela portalu.
Treść strony i wszystkie elementy strony chem24.pl podlegają ochronie prawnej zawartej w przepisach o prawie autorskim.
Niedozwolone jest kopiowanie, rozpowszechnianie i udostępnianie innym użytkownikom bez zgody autora.
Niedozwolone działania stanowią okradanie autora i podlegają przepisom zawartym w Kodeksie Karnym.
Treść strony i wszystkie elementy strony chem24.pl podlegają ochronie prawnej zawartej w przepisach o prawie autorskim.
Niedozwolone jest kopiowanie, rozpowszechnianie i udostępnianie innym użytkownikom bez zgody autora.
Niedozwolone działania stanowią okradanie autora i podlegają przepisom zawartym w Kodeksie Karnym.
