Kwasy karboksylowe
Grupa funkcyjna: grupa karboksylowa –COOH
Wzór ogólny R–COOH lub Ar–COOH (R - grupa węglowodorowa, Ar - grupa arylowa)
Nazewnictwo (*nazwa preferowana przez IUPAC)
Nazwy tworzy się z nazw węglowodorów dodając nazwę kwas i końcówkę –owy, bardzo często używa się też nazw zwyczajowych.
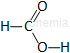 |
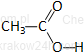 |
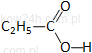 |
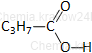 |
|
kwas mrówkowy* |
kwas octowy* |
kwas propanowy* |
kwas butanowy* |
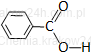 |
kwas benzoesowy* |
(R) Atom węgla w grupie karboksylowej ma hybrydyzację sp2. Grupa karboksylowa jest płaska i ma kształt trójkata, gdzie C jest atomem centralnym a w narożach trójkąta znajdują się: O, OH, R.
Jeżeli w cząsteczce kwasu występują podstawniki lub wielokrotne wiązanie, wówczas numeruje się atomy węgla - węgiel z grupy karboksylowej zawsze ma lokant 1. Cyfry używa się tylko w nazwach systematycznych.
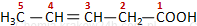 |
kwas pent-3-enowy |
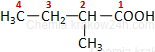 |
kwas 2-metylobutanowy |
Własności fizyczne
Cząsteczki kwasów karboksylowych są silnie zasocjowane przez obecność wiązań wodorowych. Większość kwasów występuje w postaci cyklicznych dimerów.
 |
dimer kwasu octowego |
Załóż konto
Zyskaj dostęp do artykułów, które przekształcą skomplikowane zagadnienia chemiczne w zrozumiałe i interesujące treści.
Każdy artykuł, który przeczytasz, zwiększy Twoje zrozumienie i zaciekawienie chemią.
Nie czekaj, zacznij swoją naukową podróż już dziś!
| Pełny tekst dostępny jest tylko dla zalogowanych |
Treść strony i wszystkie elementy strony chem24.pl podlegają ochronie prawnej zawartej w przepisach o prawie autorskim.
Niedozwolone jest kopiowanie, rozpowszechnianie i udostępnianie innym użytkownikom bez zgody autora.
Niedozwolone działania stanowią okradanie autora i podlegają przepisom zawartym w Kodeksie Karnym.
