Amidy
| Wzór ogólny amidów | |||||
|
|||||
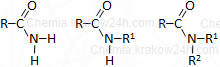 |
|||||
Nazewnictwo (*nazwa preferowana przez IUPAC)
H–CO-NH2 metanoamid, formamid* CH3−CO-NH2 etanoamid, acetamid* C6H5−CO-NH2 benzenokarboksyamid, benzamid*
| Dla amidów drugo- i trzeciorzędowych podaje się grupy przy azocie N-metyloetanoamid |
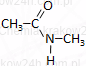 |
Masz już w sobie przekonanie, że potrzebujesz wsparcia, aby odkryć fascynujący świat chemii, w codziennej nauce i przygotowaniu do matury?
Załóż konto
Zyskaj dostęp do artykułów, które przekształcą skomplikowane zagadnienia chemiczne w zrozumiałe i interesujące treści.
Każdy artykuł, który przeczytasz, zwiększy Twoje zrozumienie i zaciekawienie chemią.
Nie czekaj, zacznij swoją naukową podróż już dziś!
Załóż konto
Zyskaj dostęp do artykułów, które przekształcą skomplikowane zagadnienia chemiczne w zrozumiałe i interesujące treści.
Każdy artykuł, który przeczytasz, zwiększy Twoje zrozumienie i zaciekawienie chemią.
Nie czekaj, zacznij swoją naukową podróż już dziś!
| Pełny tekst dostępny jest tylko dla zalogowanych |
Copyright 2011-2024Chem24.pl
Wszelkie prawa autorskie do treści zawartych w serwisie chem24.pl należą do właściciela portalu.
Treść strony i wszystkie elementy strony chem24.pl podlegają ochronie prawnej zawartej w przepisach o prawie autorskim.
Niedozwolone jest kopiowanie, rozpowszechnianie i udostępnianie innym użytkownikom bez zgody autora.
Niedozwolone działania stanowią okradanie autora i podlegają przepisom zawartym w Kodeksie Karnym.
Treść strony i wszystkie elementy strony chem24.pl podlegają ochronie prawnej zawartej w przepisach o prawie autorskim.
Niedozwolone jest kopiowanie, rozpowszechnianie i udostępnianie innym użytkownikom bez zgody autora.
Niedozwolone działania stanowią okradanie autora i podlegają przepisom zawartym w Kodeksie Karnym.
