Kwasy tlenowe
Kwas siarkowy(VI)
| Wzór sumaryczny | Wzór strukturalny |
| H2SO4 | 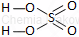 |
Schemat ciągu reakcji, w wyniku których otrzymuje się kwas siarkowy(VI)
S —O2→ SO2 —O2→ SO3 —H2O→ H2SO4
Otrzymywanie tlenku siarki(IV) SO2:
S + O2 → 2SO2
Otrzymywanie tlenku siarki(VI) SO3:
2SO2 + O2 → 2SO3
Tlenek niematalu, który reaguje z wodą i tworzy kwas nazywa się tlenkiem kwasowym.
Kwas siarkowy(VI) otrzymuje się w reakcji tlenku siarki(VI) z wodą.
SO3 + H2O → H2SO4
Tlenek siarki(VI) SO3 jest tlenkiem kwasowym kwasu siarkowego(VI)
Właściwości stężonego kwasu siarkowego(VI)
Ma właściwości żrące - powoduje zwęglenie substancji organicznych (papieru, tkaniny, cukru).
Ma własności higroskopijne - łatwo pochłania wodę i parę wodną z otoczenia.
Bezbarwna, oleista ciecz o gęstości większej niż gęstość wody
Rozcieńczanie kwasu siarkowego(VI) wodą.
Stężony kwas siarkowy(VI) ma własności żrące, więc podczas rozcieńczania go wodą należy zachować szczególną ostrożność i wlewać zawsze kwas do wody.
Do naczynia zawierającego wodę powoli dodaje się stężony kwas siarkowy(VI).
Obserwacje: kwas siarkowy(VI) spływa na dno naczynia, wzrasta temperatura roztworu
Wniosek: proces rozcieńczania kwasu siarkowego (VI) jest egzotermiczny, kwas siarkowy(VI) ma gęstość większą od gęstości wody.
Zastosowanie kwasu siarkowego(VI)
- oczyszczanie metali
- elektrolit w akumulatorach
- produkcja tworzyw sztucznych
- produkcja środków piorących i czyszczących
- produkcja leków
Kwas siarkowy(IV)
| Wzór sumaryczny | Wzór strukturalny |
| H2SO3 | 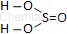 |
Kwas siarkowy(IV) można otrzymać w reakcji tlenku siarki(IV) z wodą. Tlenek siarki(IV) jest tlenkiem kwasowym.
SO2 + H2O → H2SO3
Kwas siarkowy(IV) jest nietrwały i łatwo się rozkłada.
H2SO3 → SO2 + H2O
Właściwości kwasu siarkowego(IV)
- bezbarwna ciecz
- własności wybielające
- nietrwały - łatwo ulega rozkładowi
- charakterystyczny zapach wydzielającego sie tlenku siarki(IV)
Zastosowanie kwasu siarkowego(IV)
- produkcja nawozów sztucznych
- dezynfekcja naczyń do przechowywania żywności
- w produkcji innych kwasów
- wybielanie wełny i papieru
Kwas azotowy(V)
| Wzór sumaryczny | Wzór strukturalny |
| HNO3 | 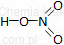 |
Właściwości kwasu azotowego(V)
Bezbarwna ciecz
Ma gęstość większą niż gęstość wody
Ma własności żrące
Powoduje żółknęcie białka
Kwas azotowy(V) można otrzymać w reakcji tlenku azotu(V) z wodą. Tlenek azotu(V) jest tlenkiem kwasowym.
N2O5 + H2O → 2HNO3
Pod wpływem stężonego kwasu azotowego(V) białko ścina się i przyjmuje żółte zabarwienie. Jest to reakcja ksantoproteinowa i służy do wykrywania białek.
Kwas węglowy
| Wzór sumaryczny | Wzór strukturalny |
| H2CO3 | 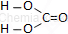 |
Kwas węglowy można otrzymać w reakcji tlenku węgla(IV) z wodą. Tlenek węgla(IV) jest tlenkiem kwasowym.
CO2 + H2O → H2CO3
Kwas węglowy jest nietrwały i łatwo się rozkłada.
H2CO3 → CO2 + H2O
Kwas fosforowy(V)
Kwas fosforowy(V) jest ciałem stałym w temperaturze pokojowej.
| Wzór sumaryczny | Wzór strukturalny |
| H3PO4 | 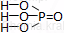 |
Kwas fosforowy(V) można otrzymać w reakcji tlenku fosforu(V) z wodą. Tlenek fosforu(V) jest tlenkiem kwasowym.
P4O10 + 6H2O → 4H3PO4
Kwasy tlenowe można otrzymać w reakcji tlenków kwasowych z wodą
tlenk kwasowy + woda → kwas tlenowy
Zapraszam do wpisania komentarza: uwagi, co jeszcze dopisać, objaśnić, sprecyzować, niezrozumiała treść, błędy itp.
Napisz komentarz
Treść strony i wszystkie elementy strony chem24.pl podlegają ochronie prawnej zawartej w przepisach o prawie autorskim.
Niedozwolone jest kopiowanie, rozpowszechnianie i udostępnianie innym użytkownikom bez zgody autora.
Niedozwolone działania stanowią okradanie autora i podlegają przepisom zawartym w Kodeksie Karnym.
