Alkeny
Węglowodory nienasycone ⇒ węglowodory, które zawierają wodór w ilości mniejszej niż maksymalnie możliwa.
Alkeny ⇒ węglowodory nienasycone zawierające wiązanie podwójne między atomami węgla.
Wzór ogólny: CnH2n
Wiązanie podwójne C=C jest krótsze i silniejsze niż wiązanie pojedyncze C−C.
Nazewnictwo alkenów
W nazwach nie podstawionych 2- i 3-węglowych alkenów lokant "1" opuszcza się (IUPAC).
CH2=CH2 eten, CH2=CH−CH3 propen
W pozostałych przypadkach musi być zachowany np. CH2=CBr−CH3 2-bromoprop-1-en
Tworzenie nazw rozgałęzionych alkenów, gdy najdłuższy łańcuch węglowy zawiera wiązanie podwójne
Krok 1. Jeśli najdłuższy łańcuch łańcuch węglowy zawiera wiązanie C=C, to strukturę wyjściową stanowić będzie eten, propen, buten... itd. Każdą nazwę kończy się końcówką –en.
Krok 2. Oznacz liczbami atomy węgla zaczynając od atomu najbliżej położonego od wiązania podwójnego.
Krok 3. Dla łańcucha zawierającego więcej niż 3 atomy węgla podaj miejsce położenia wiązania podwójnego i wtedy końcówka wygląda tak: -1-en, -2-en, -3-en, -4-en.
Przykład. Penten C5H10.
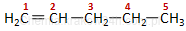 |
pent−1-en |
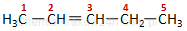 |
pent−2-en |
Krok 4. Na początku nazwy dodaj miejsca położenia grup alkilowych, jeśli takie są obecne.
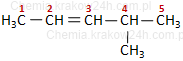 |
4-metylopent-2-en |
WAŻNE UWAGI zgodne z IUPAC
1. Użycie nazw 1-penten, 2-penten itp. jest błędne. Lokanty używa się przed częścią nazwy, której dotyczą.
2. Jeśli w cząsteczce znajduje się łańcuch węglowy nie zawierający wiązania podwójnego, który jest dłuższy niż łańcuch węglowy zawierający wiązanie podwójne, wówczas ten pierwszy jest ważniejszy i stosuje się inne zasady nazewnictwa (nie końcówkę -en)
Nazewnictwo zwyczajowe
H2C=CH- winyl np. chlorek winylu H2C=CHCl
H2C=CH−CH2− allil np. chlorek allilu H2C=CH−CH2Cl
Własności fizyczne zmieniają się podobnie jak w alkanach - wraz z długością łańcucha węglowego wzrasta temperatura wrzenia, topnienia, gęstość.
Załóż konto
Zyskaj dostęp do artykułów, które przekształcą skomplikowane zagadnienia chemiczne w zrozumiałe i interesujące treści.
Każdy artykuł, który przeczytasz, zwiększy Twoje zrozumienie i zaciekawienie chemią.
Nie czekaj, zacznij swoją naukową podróż już dziś!
| Pełny tekst dostępny jest tylko dla zalogowanych |
Treść strony i wszystkie elementy strony chem24.pl podlegają ochronie prawnej zawartej w przepisach o prawie autorskim.
Niedozwolone jest kopiowanie, rozpowszechnianie i udostępnianie innym użytkownikom bez zgody autora.
Niedozwolone działania stanowią okradanie autora i podlegają przepisom zawartym w Kodeksie Karnym.
