Fenole
Fenole - grupa związków, w których grupa hydroksylowa –OH jest związana bezpośrednio z atomem węgla pierścienia aromatycznego.
Wzór ogólny: Ar-OH (Ar – grupa arylowa)
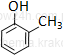
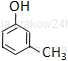
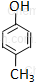
Nazwy związków grupy fenoli tworzy się od fenolu. (* nazwa preferowana przez IUPAC)
 |
 |
 |
 |
|
fenol* |
2-metylofenol* |
3-metylofenol* |
4-metylofenol* |
| Metylofenole - homologi fenolu. | |||
Własności fizyczne
Bezbarwny, krystaliczny, higroskopijny. Pod wpływem powietrza powoli przybiera barwę ciemnobrunatną (utlenia się). Topi się w temp. 41oC, t. wrzenia 182oC. Fenole to związki polarne, tworzą międzycząsteczkowe wiązania wodorowe, przez co ich temperatury wrzenia są wyższe niż inne, porównywalne związki aromatyczne. W wodzie rozpuszcza się średnio, w etanolu, glicerolu, benzenie, eterze - dobrze.
Otrzymywanie fenolu
Reakcja chlorobenzenu z wodorotlenkiem sodu
C6H5Cl + 2NaOH → C6H5ONa + NaCl + H2O
Pod wpływem kwasu solnego fenolan sodu ulega rozkładowi.
C6H5ONa + HCl → C6H5OH + NaCl
Właściwości chemiczne
Wodny roztwór fenolu ma odczyn słabo kwasowy.
C6H5OH ⇄ C6H5O– + H+ C6H5O– - anion fenoksylanowy (fenolanowy)
W cząsteczce fenolu następuje przesunięcie niewiążących par elektronowych tlenu w kierunku pierścienia – wiązanie między atomem tlenu a atomem wodoru słabnie i ułatwia to odszczepienie kationu wodoru. Pierścień aromatyczny powoduje zwiększenie kwasowości grupy -OH w porównaniu z alkoholami.
Załóż konto
Zyskaj dostęp do artykułów, które przekształcą skomplikowane zagadnienia chemiczne w zrozumiałe i interesujące treści.
Każdy artykuł, który przeczytasz, zwiększy Twoje zrozumienie i zaciekawienie chemią.
Nie czekaj, zacznij swoją naukową podróż już dziś!
| Pełny tekst dostępny jest tylko dla zalogowanych |
Treść strony i wszystkie elementy strony chem24.pl podlegają ochronie prawnej zawartej w przepisach o prawie autorskim.
Niedozwolone jest kopiowanie, rozpowszechnianie i udostępnianie innym użytkownikom bez zgody autora.
Niedozwolone działania stanowią okradanie autora i podlegają przepisom zawartym w Kodeksie Karnym.
