Mechanizm addycji elektrofilowej
Reakcje addycji przebiegają w fazie ciekłej, bezwodnej, w niskich temperaturach.
Elektrofile i nukleofile
Elektrofil to kationy lub cząsteczka obojętna z dużym cząstkowym ładunkiem dodatnim na jednej z części cząsteczki. Może on utworzyć wiązanie w wyniku przejęcia pary elektronowej pochodzącej od nukleofila.
Przykłady elektrofili:
Cl+ kation chloroniowy, NO3+ kation nitroniowy, SO3H+ kation sulfoniowy
AlCl3 - ma deficyt elektronowy (jeden pusty orbital elektronowy)
SO3 tlenek siarki(VI), karbokation RH2+
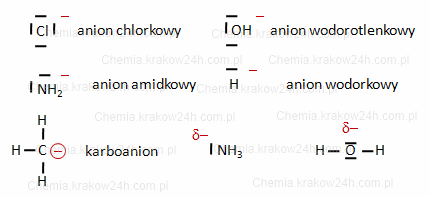
Nukleofil to anion lub cząsteczka obojętna, która ma duże bogactwo elektronów lub wolną parę elektronową
Przykłady nukleofili
Masz już w sobie przekonanie, że potrzebujesz wsparcia, aby odkryć fascynujący świat chemii, w codziennej nauce i przygotowaniu do matury?
Załóż konto
Zyskaj dostęp do artykułów, które przekształcą skomplikowane zagadnienia chemiczne w zrozumiałe i interesujące treści.
Każdy artykuł, który przeczytasz, zwiększy Twoje zrozumienie i zaciekawienie chemią.
Nie czekaj, zacznij swoją naukową podróż już dziś!
Załóż konto
Zyskaj dostęp do artykułów, które przekształcą skomplikowane zagadnienia chemiczne w zrozumiałe i interesujące treści.
Każdy artykuł, który przeczytasz, zwiększy Twoje zrozumienie i zaciekawienie chemią.
Nie czekaj, zacznij swoją naukową podróż już dziś!
| Pełny tekst dostępny jest tylko dla zalogowanych |
Copyright 2011-2024Chem24.pl
Wszelkie prawa autorskie do treści zawartych w serwisie chem24.pl należą do właściciela portalu.
Treść strony i wszystkie elementy strony chem24.pl podlegają ochronie prawnej zawartej w przepisach o prawie autorskim.
Niedozwolone jest kopiowanie, rozpowszechnianie i udostępnianie innym użytkownikom bez zgody autora.
Niedozwolone działania stanowią okradanie autora i podlegają przepisom zawartym w Kodeksie Karnym.
Treść strony i wszystkie elementy strony chem24.pl podlegają ochronie prawnej zawartej w przepisach o prawie autorskim.
Niedozwolone jest kopiowanie, rozpowszechnianie i udostępnianie innym użytkownikom bez zgody autora.
Niedozwolone działania stanowią okradanie autora i podlegają przepisom zawartym w Kodeksie Karnym.
